| Article Index |
|
Правила составления, изложения и оформления стандартов качества на фармацевтические субстанции. II. Правила составления стандартов качества предприятия на субстанции
|
|
Правила и порядок изложения
|
|
Спецификация
|
|
Начало стандарта
|
|
Эмпирическая формула
|
|
Относительная молекулярная масса
|
|
Содержание действующего вещества
|
|
Описание
|
|
Растворимость
|
|
Подлинность
|
|
Температура плавления
|
|
Температура затвердевания, Температура кипения (температурные пределы перегонки), Плотность, Вязкость, Показатель преломления
|
|
Удельное вращение
|
|
Удельный показатель поглощения
|
|
Прозрачность и цветность раствора
|
|
рН или Кислотность или щелочность раствора
|
|
Посторонние примеси (родственные соединения)
|
|
Посторонние примеси. Метод ТСХ
|
|
Посторонние примеси. Метод ВЭЖХ
|
|
Неорганические анионы (хлориды, сульфаты и др.)
|
|
Неорганические катионы (железо, медь и др.)
|
|
Сульфатная зола
|
|
Тяжелые металлы
|
|
Мышьяк
|
|
Потеря в массе при высушивании или Вода
|
|
Остаточные органические растворители
|
|
Аномальная токсичность, Пирогенность, Бактериальные эндотоксины, Гистамин и депрессорные вещества.
|
|
Аномальная токсичность
|
|
Пирогенность
|
|
Бактериальные эндотоксины
|
|
Гистамин (1) и Депрессорные вещества (2)
|
|
Микробиологическая чистота. Стерильность.
|
|
Количественное определение
|
|
Количественное определение. Метод ВЭЖХ
|
|
Упаковка, Хранение
|
|
Маркировка
|
|
Срок годности
|
|
Назначение
|
|
Стандартные образцы.
|
|
All Pages
|
There are no translations available.
Cодержание
Правила составления, изложения и оформления стандартов качества на фармацевтические субстанции Методические рекомендации (вступление)
Введение
I Порядок представления стандартов качества предприятия на фармацевтическую субстанцию на экспертизу и согласование
II. Правила составления стандартов качества предприятия на субстанции
III. Макет нормативной документации на субстанцию
II. Правила составления стандартов качества предприятия на субстанции
Приведенные правила в первую очередь распространяются на индивидуальные органические вещества строго установленного строения.
Для субстанций, представляющих собой стандартизованную смесь биологически активных веществ растительного или животного происхождения, а также неорганических веществ, возможны отклонения от данных требований или дополнительные требования.
Титульный лист
Спецификации
Все показатели качества, содержащиеся в нормативной документации, должны быть представлены в сводной таблице — Спецификации.
Перечень разделов нормативной документации и последовательность их изложения
1. Торговое название на русском языке
2. Международное непатентованное название (МНН) на русском языке
З. Химическое название на русском языке в соответствии с номенклатурой IUPAC
4. Структурная формула
5. Эмпирическая формула
б. Относительная молекулярная масса
7. Содержание действующего вещества (в процентах или ЕД)
8. Описание
9. Растворимость
10. Подлинность
11. Температура плавления, или Температура затвердевания, или Температура кипения
12. Плотность
13. Удельное вращение
14. Удельный показатель поглощения
15. Показатель преломления
16. Прозрачность раствора
17. Цветность раствора
18. рН или Кислотность или щелочность раствора
19. Механические включения
20. Посторонние примеси (родственные соединения)
21. Хлориды, Сульфаты и другие неорганические анионы
22. Железо, Медь и другие неорганические катионы
23. Сульфатная зола
24. Тяжелые металлы
25. Мышьяк
26. Потеря в массе при высушивании или Вода
27. Остаточные органические растворители
28. Бактериальные эндотоксины или Пирогенность
29. Аномальная токсичность
30. Гистамин и / или депрессорные вещества
31. Микробиологическая чистота или Стерильность
32. Количественное определение
33. Упаковка
34. Маркировка
35. Транспортирование
36. Хранение
37. Срок годности
38. Назначение
39. Меры предосторожности
Примечание.
1. Разделы 1—10, 20, 26, 31—34, 36—38 являются обязательными. Включение остальных и при необходимости дополнительных разделов зависит от природы вещества (субстанции), технологии его получения и лекарственных форм, которые будут изготавливаться из данной субстанции.
2. Нумерация разделов в нормативной документации не приводится.
3. Заголовки разделов приводятся с красной строки и выделяются полужирным шрифтом.
Правила и порядок изложения
Титульный лист
Должен быть оформлен в соответствии с Макетом нормативной документации на субстанцию. Указывается торговое название субстанции, международное непатентованное название (если оно имеется), название и страна компании — держателя регистрационного удостоверения, участников производственного процесса (упаковщика, фасовщика, выпускающего контроль качества).
Спецификация
Последовательность изложения разделов в Спецификации и нормативной документации должна совпадать.
Спецификация включает в себя нормы на срок годности субстанции. Показатели качества, включенные в спецификацию и нормативную документацию, проверяются для каждой серии субстанции в полном объеме.
Разделы нормативной документации
В начале стандарта качества предприятия приводится
Торговое название
Международное непатентованное название (МНН).
Химическое название в соответствии с номенклатурой IUРАС.
Структурная формула
Эмпирическая формула
В эмпирической формуле первым пишется углерод, вторым — водород, следующие элементы, включая металлы, располагаются в алфавитном порядке: например, С12Н17СIN40S·НСl.
Относительная молекулярная масса
Относительная молекулярная масса должна быть указана в соответствии с Государственной фармакопеей РФ и дана до второго знака после запятой для относительной молекулярной массы, не превышающей 400, и до первого знака после запятой для относительной молекулярной массы свыше 400.
Содержание действующего вещества
Содержание действующего вещества указывается в процентах или в единицах действия.
Количественное определение должно учитывать точность метода и чистоту вещества.
Содержание действующего вещества дается
- в пересчете на сухое вещество, если в нормативном документе определяется "Потеря в массе при высушивании";
- в пересчете на безводное вещество, если в нормативном документе определяется "Вода";
- в пересчете на безводное и не содержащее органических растворителей вещество, если в нормативном документе определяется и "Вода", и "Остаточные органические растворители" (если нормируется содержание-остаточных органических растворителей в заметных количествах).
Для неспецифичного метода количественного определения (например, титриметрия) содержание нормируется обычно от 99,0 до 101,0%. Если не указан верхний предел содержания, следует считать, что он составляет не более 100,5%.
Для специфичного метода количественного определения, основанного на методиках разделения (например, жидкостная или газовая хроматография), содержание нормируется обычно от 98,0 до 102,0%.
Описание
В разделе указывают характеристики физического состояния и цвет субстанции. Не следует включать описание вкуса. В необходимых случаях приводят информацию о запахе и гигроскопичности. При характеристике цвета следует использовать название основных цветов спектра: желтый, зеленый, оранжевый, красный и др. Следует избегать других терминов для указания цвета (персиковый, бежевый, лимонный и т.д.). При составных цветах на первом месте указывают тот цвет, который содержится в меньшей доле, а затем через дефис — преобладающий цвет (например, оранжево-красный).
Для характеристики запаха следует использовать термины; «без запаха», «практически без запаха», «с характерным запахом», "со слабым характерным запахом».
Для твердых субстанций необходимо указание "кристаллический", "мелкокристаллический" или "аморфный порошок". Характеристика кристалличности субстанции является одним из важных параметров, от которого зависит качество твердых дозированных лекарственных форм.
Крупнокристаллический порошок. Не более 40 % частиц порошка должно быть размером менее 0,4 мм.
Кристаллический порошок. Не менее 95% частиц порошка должно быть размером менее 0,4 мм и не более 40 % размером менее 0,2 мм.
Мелкокристаллический порошок. Не менее 95 % частиц порошка должно быть размером менее 0,2 мм.
В некоторых случаях может быть указан численный диапазон размера частиц, а также введено исследование формы кристаллов. Такие испытания выносят в отдельные разделы.
Оценка полиморфизма субстанции обязательна в тех случаях, когда полиморфная модификация определяет фармакологическую активность готовой лекарственной формы и её фармакотехнологические свойства.
Растворимость
Растворимость субстанции отражает стабильность технологического процесса, может характеризовать чистоту субстанции и различные полиморфные модификации субстанции.
Для определения растворимости рекомендуется использовать растворители, охватывающие широкую шкалу полярности, например; вода, спирт 96 %, ацетон, гексан. Не рекомендуется использование легкокипящих и легковоспламеняющихся (например, диэтиловый эфир) или токсичных (например, бензол) растворителей.
Данные приводят в порядке уменьшения степени растворимости.
Подлинность
Для установления подлинности субстанции рекомендуется оптимальное сочетание физико-химических и химических методов: ИК-спектроскопии, абсорбционной спектрофотометрии, хроматографии (ТСХ, ГХ и ВЭЖХ) и качественных химических реакций.
Метод ИК-спектроскопии является приоритетным при идентификации субстанций. При установлении подлинности методом ИК-спектроскопии рекомендуется снимать спектры на Фурье-спектрометрах и использовать фармакопейные стандартные образцы (USP RS, ЕР CRS, BP CRS и др.) или стандартные рисунки спектров, включенные в фармакопеи. Полиморфные модификации одного и того же вещества могут давать различные спектры. В этом случае для проверки идентичности сопоставляют спектры растворов или, растворов каждое вещество (субстанцию и стандартный образец) в одном и том же растворителе, упаривают раствор досуха и сравнивают спектры твердых остатков.
Не рекомендуется для подтверждения подлинности включать определение запаха.
Температура плавления
Испытание обычно применяют для характеристики твердых веществ.
Для определения температуры плавления в зависимости от физических свойств вещества применяют капиллярный метод, открытый капиллярный метод, метод мгновенного плавления и метод каплепадения.
Для веществ, неустойчивых при нагревании, определяют температуру разложения.
Температура затвердевания, Температура кипения (температурные пределы перегонки), Плотность, Вязкость, Показатель преломления
Данные испытания вводят, как правило, для характеристики жидких субстанций.
Удельное вращение
Вводят для характеристики оптически активных веществ.
Поскольку оптически активные субстанции и их рацематы нередко обладают разной биологической активностью (например, амлодипина бесилат, циталопрам, атенолол и др.) и технология и источники получения могут влиять на чистоту субстанции, контроль по показателю "Удельное вращение" приобретает всё большую значимость.
Удельный показатель поглощения
Данный показатель является-дополнительной характеристикой подлинности и чистоты субстанции.
Прозрачность и цветность раствора
Данные испытания обязательны для субстанций, используемых для приготовления парентеральных, глазных, назальных и ушных лекарственных средств.
Рекомендуется проводить испытание в водных растворах субстанций, концентрация которых приближена к концентрации, изготавливаемой из этой субстанции лекарственной формы.
Оценка прозрачности выполняется для веществ, которые образуют бесцветные или слабо окрашенные растворы.
Определение цветности раствора особенно важно для оценки качества белых, почти белых или белых с оттенком субстанций, т.к. данный показатель характеризует их чистоту.
Если субстанция окрашена, показатель «Цветность раствора» в нормативный документ включать не следует. Испытание для окрашенных субстанций можно заменить регламентацией оптической плотности при определенных длинах волн (обычно в области от 400 до 450 нм).
рН или Кислотность или щелочность раствора
Для проведения данного испытания могут использоваться два подхода: измерение рН или кислотно-основное титрование (кислотность или щелочность). Определение рН, как правило, дает характеристику кислотно-основных свойств действующего вещества, а определение кислотности (щелочности) может характеризовать наличие примесных соединений. Допустимый интервал рН обычно не должен превышать 2 единицы. Если вещество имеет буферные свойства, то предпочтительнее определять рН. В иных случаях рекомендуется титриметрическая процедура. Испытание кислотности (щелочности) применяется также в случае нерастворимых в воде субстанций.
Посторонние примеси (родственные соединения)
Данное испытание контролирует продукты деструкции и технологические примеси. При обосновании спецификации следует представить данные о природе примесей, причине их присутствия (полупродукт синтеза или продукт деструкции). для контроля примесей обычно используют хроматографические и, ре)ке, спектроскопические методы. Обязательно вводится идентификация и количественное определение токсичных примесей с использованием стандартных образцов.
Чтобы избежать использования дорогостоящих и труднодоступных стандартных образцов примесей, в хроматографических методах анализа для оценки разделительной способности системы возможно использование приема «искусственного старения» — частичной деградации субстанции в стрессовых условиях, например, при повышенной температуре, или ее модификации в результате реакций гидролиза, окисления, галоидирования, термо- и фотодеструкции и т.п. (в зависимости от химической природы субстанции). Цель такой обработки получить возможные продукты разложения определяемого вещества и/или соединения, близкие по химической структуре к определяемому веществу, которые затем можно использовать для проверки разделяющей способности хроматографической системы.
При применении хроматографических методов для определения неидентифицированных примесей, в тех случаях, когда пределы обнаружения примеси и субстанции близки, допускается использование испытуемой субстанции в необходимых разведениях для нормирования содержания примесей, при этом обязательно установление предела допустимого количества единичных примесей и их суммы (при использовании метода ТСХ в некоторых случаях указывается допустимое количество пятен).
Метод ВЭЖХ является более предпочтительным при контроле примесей, чем ТСХ.
При использовании метода ТСХ порядок изложения раздела «Посторонние примеси» должен быть следующим:
Посторонние примеси. Метод ТСХ
Используемые реактивы: с указанием категории (квалификации), фирмы-производителя, каталожного номера (в тех случаях, когда реактивы не описаны в ГФ) с добавлением — "или аналогичного качества".
Используемые стандартные образцы: Приводится перечень с указанием химических названий, квалификации, производителя (при необходимости).
Описание приготовления всех растворов, используемых в методике, с указанием допустимых сроков годности и условий хранения приготовленных растворов в следующей последовательности:
Растворы реактивов подвижная фаза с описанием приготовления вспомогательных растворов, входящих в ее состав (описание приводится при необходимости); раствор для детектирования (при его использовании)
Испытуемый раствор
Раствор(-ы) стандартного(-ых) образца(-ов) или Раствор(-ы) сравнения
Раствор для проверки пригодности хроматографической системы.
Описание методики: приводится используемая пластинка, для которой следует указать размер, толщину слоя, фирму-производитель и каталожный номер с указанием слов "или аналогичная" (рекомендуется приводить не менее двух альтернативных коммерческих марок пластинок); объем наносимой пробы и количества вещества (объемы проб должны быть одинаковыми); подвижная фаза (ПФ); величина пробега ПФ; условия высушивания и способ детектирования; оценка результатов и нормы.
Определение пригодности хроматографической системы. При проведении испытаний, регламентирующих наличие посторонних примесей/родственных соединений, должно быть предусмотрено определение чувствительности обнаружения определяемых примесей и разделительной способности хроматографической системы.
При использовании метода ВЭЖХ порядок изложения раздела "Посторонние примеси" должен быть следующим:
Посторонние примеси. Метод ВЭЖХ
Используемые реактивы: с указанием категории (квалификации), фирмы-производителя, каталожного номера (в тех случаях, когда они не описаны в ГФ) с добавлением — "или аналогичного качества".
Используемые стандартные образцы: приводится перечень с указанием химических названий, квалификации, производителя (при необходимости).
Описание приготовления всех растворов, используемых в методике, с указанием допустимых сроков годности и условий хранения приготовленных растворов в следующей последовательности:
Растворы реагентов (при необходимости)
Буферный раствор рН ... (при необходимости)
Подвижная фаза (с описанием приготовления вспомогательных растворов, входящих в состав подвижной фазы) (при необходимости)
Испытуемый раствор
Раствор(-ы) стандартного(-ых) образца(-ов) или Раствор(-ы) сравнения
Раствор для проверки пригодности хроматографической системы.
Хроматографические условия
Колонка - Указывается размер колонки, сорбент, размер частиц. Рекомендуется указывать как минимум две альтернативные колонки.
Допускается использование альтернативной колонки, удовлетворяющей требованиям пригодности хроматографической системы.
Подвижная фаза (ПФ)
Скорость потока
Детектор - для УФ-детектора указывают длину волны.
Температура колонки - Указывается конкретная температура.
Объем пробы
Время хроматографирования - Рекомендуется указывать относительно времени выхода действующего вещества
В случае использования линейного градиента следует приводить запись в виде таблицы с обозначениями времени и состава подвижной фазы.
Определение пригодности хроматографической системы. Приводится описание методики определения и указываются требования к разделительной способности (разрешение R или коэффициент p/v), эффективности колонки N (количество теоретических тарелок), фактору асимметрии Т (при необходимости) и относительному стандартному отклонению площадей пиков RSD.
Замечания по процессу. Указывается, как при необходимости могут быть изменены условия хроматографирования для достижения критериев пригодности хроматографической системы (например, как влияет изменение содержания того или иного компонента подвижной фазы на времена удерживания и какие изменения состава подвижной фазы в этой связи допустимы); каким образом должна быть кондиционирована колонка, каким растворителем промывается колонка после использования и как она консервируется, если эти специальные требования необходимы для стабильной работы колонки, а также другие уточнения, которые могут облегчить проведение испытаний в процессе контроля качества субстанции и предотвратить нежелательный контакт колонки с компонентами подвижной фазы или пробы.
Указывается, какие пики не принимаются в расчет, если они не влияют на результат оценки качества субстанции, а связаны с методической особенностью.
Методика определения. Приводится подробное описание всех этапов выполнения методики, требующих особого внимания, ориентировочные значения Rr примесей относительно лекарственного вещества, развернутая формула расчета с расшифровкой обозначений в формуле и указанием размерности используемых величин, оценка результатов и нормы содержания.
Неорганические анионы (хлориды, сульфаты и др.)
Выбор контролируемых анионов определяется технологией получения субстанции. При этом контролируемые анионы могут быть нетоксичными (например, хлориды сульфаты и т.д.).
Контроль анионов не вводят, если они входят в состав субстанции (например, вещество является гидрохлоридом или сульфатом).
Неорганические катионы (железо, медь и др.)
Это испытание вводят, если контроль содержания отдельных катионов является существенным для качества субстанции; их содержание должно быть обосновано.
Контроль катионов не вводят, если они входят в состав субстанции (например, вещество является натриевой солью).
Сульфатная зола
Испытание позволяет оценивать содержание катионов металлов, присутствующих в органических субстанциях в виде оксидов и сульфатов металлов. Как правило, сульфатная зола не должна превышать 0,1 %. Отсутствие этого испытания в нормативной документации или повышенное содержание сульфатной золы требует соответствующего обоснования.
Тяжелые металлы
Источниками попадания тяжелых металлов в субстанцию являются исходное сырье, применяемые в синтезе катализаторы и элементы аппаратуры. Данный показатель не вводится для субстанций, содержащих ион тяжелых металлов в ее составе (субстанция в виде соли или комплекса с тяжелым металлом). В нормативной документации приводят описание приготовления испытуемого раствора и указывают метод определения. Содержание тяжелых металлов не должно превышать 0,001 %, если нет других указаний в нормативной документации.
Мышьяк
Данное испытание вводят в том случае, когда исходное сырье может содержать мышьяк, например, для сырья природного происхождения, или возможно загрязнение им в процессе получения субстанции. Содержание мышьяка, как правило, не должно превышать 0,0001 %.
Потеря в массе при высушивании или Вода
Испытание вводят для контроля содержания летучих веществ и/или воды в субстанции. Введение одного из этих испытаний, как правило, обязательно. Отсутствие их должно быть обосновано. Результаты определения по этим показателям учитываются при оценке результатов количественного определения.
Показатель «Потеря в массе при высушивании» показывает суммарное содержание в субстанции веществ, температура кипения которых не превышает температуру высушивания — обычно вода и органические растворители, температура кипения которых ниже 100 °С (если высушивание проводят при 100—105 °С).
Указывают навеску субстанции, способ пробоподготовки (например, измельчение), если требуется, и условия сушки.
В случае, если:
- при сушке субстанции возможно её термическое разложение,
- субстанция является кристаллогидратом (кристаллосольватом),
- субстанция имеет высокое значение парциального давления пара, и как следствие, способна к испарению или возгонке;
- субстанция высокогигроскопична;
- присутствие воды в субстанции приводит к гидролизу действующего вещества или изменению свойств субстанции, вместо определения потери в массе при высушивании проводят определение воды и остаточных органических растворителей.
В разделе «Вода» указывают навеску субстанции, способ пробоподготовки (например, измельчение), если требуется, и условия определения.
Для кристаллогидратов норма устанавливается «от ... до ...» из отношения молекулярной массы воды в гидратной форме к молекулярной массе гидрата, исходя из эмпирической химической формулы, в остальных случаях - "не более . . . ".
Если нет других указаний в нормативной документации и субстанция не является кристаллогидратом (кристаллосольватом), потеря в массе при высушивании или содержание воды не должно превышать 0,5 %.
Остаточные органические растворители
Содержание остаточных количеств органических растворителей, использующихся при получении субстанции, должно соответствовать требованиям ОФС "Остаточные органические растворители".
Контроль содержания остаточных растворителей обычно проводят методом газовой хроматографии.
Порядок изложения раздела должен быть следующим.
Остаточные-органические растворители
Приводятся нормы содержания остаточных органических растворителей.
Используемые реактивы: с указанием категории (квалификации), фирмы-производителя, каталожного номера (в тех случаях, когда они не описаны в ГФ) с добавлением "или аналогичного качества".
Используемые стандартные образцы (перечень, квалификация) (указываются при необходимости).
Описание приготовления всех растворов, используемых в методике (с указанием допустимых сроков годности и условий хранения приготовленных растворов) в следующей последовательности:
Раствор внутреннего стандарта (при его использовании)
Испытуемый раствор
Раствор(-ы) стандартного(-ых) образца(-ов) или Раствор(-ы) сравнения
Раствор для проверки пригодности хроматографической системы.
Хроматографические условия
Колонка - Указывают тип (рекомендуется указывать как минимум две альтернативные колонки), материал, из которого сделана колонка и её геометрические размеры, состав или название неподвижной фазы (НФ), толщину пленки НФ; для набивных колонок указывают название сорбента, размер частиц) модификацию поверхности (если необходимо). Допускается использование альтернативной колонки, удовлетворяющей требованиям пригодности хроматографической системы
Газ-носитель - Указывают название, скорость потока/давление/деление потока
Кондиционирование колонки
Температура термостата колонки - Указывают температуру и время. При использовании температурной программы указывают температуру и время
Температура инжектора
Температура детектора
Объем пробы
Способ ввода пробы
Детектор - Способ детектирования. Для пламенно-ионизационного детектора указывают скорость подачи/давление воздуха и скорость подачи/давление водорода
Время хроматографирования
Проверка пригодности хроматографической системы. Приводится описание методики определения, указываются требования к раздели- тельной способности (если определяются два или более растворителей), эффективности колонки, фактору асимметрии пиков и относительному стандартному отклонению площадей пиков.
Замечания по процессу. Указывается, как при необходимости могут быть изменены условия хроматографирования для достижения критериев пригодности хроматографической системы, а также другие уточнения, которые могут облегчить проведение испытаний в процессе контроля качества субстанции.
Методика определения. Приводится подробное описание всех этапов выполнения методики, требующих особого внимания, развернутая формула расчета с расшифровкой обозначений в формуле и указанием размерности используемых величин.
Аномальная токсичность, Пирогенность, Бактериальные эндотоксины, Гистамин и депрессорные вещества.
Вид, пол, возраст и масса животных должны соответствовать указаниям соответствующих общих фармакопейных статей. (ОФС).
Для биологических испытаний следует готовить растворы, эмульсии или суспензии проверяемых субстанций на растворителях, которые могут быть введены животным. Если субстанция плохо растворима, то следует описать условия ее растворения в соответствующем разделе нормативной документации.
В биологических разделах расчет навесок должен проводиться с учетом содержания действующего вещества. Для антибиотиков - это активное вещество без примесей и ионной части молекулы.
При растворении больших навесок в небольшом объеме жидкости следует учитывать увеличение объёма полученного раствора, по этому для приготовления раствора помещают точную навеску испытуемой субстанции в стерильную мерную колбу и растворяют в небольшом количестве воды для инъекций или растворителя, указанного в нормативной документации, а затем доводят объем раствора до метки.
Расчет массы навесок
Для проведения испытания готовят растворы субстанции в концентрации, соответствующей указаниям нормативной документации. В тех случаях, когда содержание активного вещества составляет менее 100 % от массы, навеску следует рассчитывать по формуле:
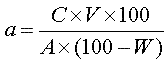 [1], [1],
где: а - масса навески, в миллиграммах;
С - количество активного вещества, необходимое для приготовления 1 мл испытуемого раствора, с концентрацией, рассчитанной с учетом величины тест-дозы, указанной в нормативной документации;
V - объем испытуемого раствора, необходимый для проведения анализа, в миллилитрах;
А - активность субстанции в весовых единицах или в единицах активности на 1 миллиграмм;
W - содержание воды, в процентах.
Примеры:
При анализе по показателю "Аномальная токсичность" для приготовления 5 мл испытуемого раствора субстанции цефтриаксона натрия с активностью А = 0,935 мг/мг при содержании воды W = 9,9 % и тест-дозой 30 мг/0,5 мл навеску рассчитывают, внося эти данные в формулу [1]:
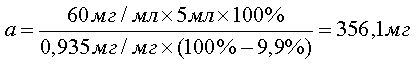 [2], [2],
При анализе по показателю «Пирогенность» для приготовления 15 мл испытуемого раствора этой субстанции при тест-дозе 50 мг/мл, расчет навески проводят таким же образом:
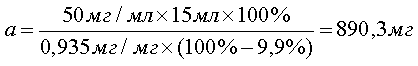 [3], [3],
Аномальная токсичность
При испытании на токсичность в субстанциях выявляют наличие нежелательных примесей. Проверке, как правило, подвергают вещества природного происхождения. Обязательному контролю подлежат субстанции, получаемые из крови, органов, тканей человека или животного, из микроорганизмов и продуктов их жизнедеятельности, из растительного сырья при изготовлении из них готовых лекарственных форм в основном для парентерального применения.
Введение исследуемой субстанции в организм животного должно осуществляться внутривенным путем, гарантирующим наиболее полное поступление лекарственного вещества, и поэтому этот способ введения является основным.
При испытании препарата для внутривенного применения, недопустимо введение раствора субстанции животным иным путем. При использовании внесосудистого пути введения — внутримышечного или подкожного должна быть доказана невозможность внутривенного введения.
Для оригинальных (или впервые регистрируемых) субстанций при включении раздела «Аномальная токсичность» в обосновании спецификации следует привести значения ЛД50 и ЛД10, определенные в экспериментах на 3-х сериях субстанции на различных сроках хранения. На основании полученных данных обосновывают выбор тест-дозы и путь введения.
В разделе "Аномальная токсичность" должны быть указаны:
1. Тест-доза
2. Растворитель
3. Объём вводимой тест-дозы
4. Путь введения - В том случае, если эти требования отличаются от требований ОФС
5. Время введения - В том случае, если эти требования отличаются от требований ОФС
6. Срок наблюдения
В тексте раздела нормативной документации также следует описать симптомы интоксикации, если таковые наблюдаются после введения испытуемой субстанции.
Пирогенность
Испытанию на пирогенность подлежат субстанции, предназначенные для производства парентеральных лекарственных форм. Субстанции должны проверяться на пирогенность в том виде, в котором они используются для приготовления готовых лекарственных форм. дополнительная депирогенизация субстанции нежелательна.
Основной путь введения раствора субстанции кроликам — внутривенный. При испытании препарата для внутривенного применения недопустимо введение раствора субстанции животным иным путем. При использовании внесосудистого пути введения внутримышечного или подкожного — в обосновании спецификации должна быть доказана невозможность внутривенного введения раствора субстанции.
При включении раздела "Пирогенность" в проект нормативной документации в обосновании предлагаемых требований:
1) рекомендуется указать величину максимальной терапевтической дозы, которую вводят пациенту согласно Инструкции по медицинскому применению на лекарственный препарат, изготавливаемый из данной субстанции;
2) следует привести выбор и обоснование тест-дозы для введения кроликам при испытании;
3) выбранная тест-доза должна обеспечивать надежность проверки качества субстанции для предотвращения пирогенных реакций у больных.
В разделе "Пирогенность" должны быть указаны:
1. Тест-доза
2. Растворитель
3. Объём вводимой тест-дозы
4. Путь введения - В том случае, если эти требования отличаются от требований ОФС
5. Время введения - В том случае, если эти требования отличаются от требований ОФС
Бактериальные эндотоксины
Контролю по показателю "Бактериальные эндотоксины" с помощью ЛАЛ-теста подлежат субстанции, которые предназначены для приготовления парентеральных лекарственных форм. Субстанции должны проверяться в том виде, в котором они используются в производстве готовых лекарственных форм. Дополнительная депирогенизация субстанции нежелательна.
По сравнению с испытанием на пирогенность, проводимом в опытах на кроликах, ЛАЛ-тест является более чувствительным и точным методом для выявления содержания бактериальных эндотоксинов в растворах. Кроме того, ЛАЛ-тест возможно использовать для контроля качества субстанций, нерастворимых в воде. В отличие от испытания на кроликах, ЛАЛ-тест является процедурой, которая валидируется.
Если на стадии доклинического изучения доказано, что субстанция не обладает пирогенными свойствами и в процессе производства не может быть загрязнена пирогенными примесями не бактериальной природы, то следует проводить контроль ее качества с помощью ЛАЛ-теста.
При включении раздела - "Бактериальные эндотоксины" в проект нормативной документации при обосновании предлагаемых требований:
1) рекомендуется указать величину максимальной терапевтической дозы, которую вводят пациенту в течение одного часа, согласно Инструкции по медицинскому применению на лекарственный препарат, изготавливаемый из данной субстанции;
2) следует привести:
- норму содержания бактериальных эндотоксинов, рассчитанную на основе вышеуказанной величины с учетом международных требований к количеству бактериальных эндотоксинов, безопасному для человека при выбранном парентеральном пути введения;
- результаты валидационной процедуры методики ЛАЛ-теста для данной субстанции;
3) выбранная норма предельного содержания бактериальных эндотоксинов должна обеспечивать надежность проверки качества субстанции для предотвращения пирогенных реакций у больных.
В разделе «Бактериальные эндотоксины» должны быть указаны:
1. Норма содержания бактериальных эндотоксинов
2. Растворитель
3. Концентрация исходного раствора
4. Особенности растворения (для нерастворимых субстанций: предварительное измельчение, нагревание, интенсивное перемешивание и прочее).
Гистамин (1) и Депрессорные вещества (2)
Испытанию на гистамины и депрессорные вещества подлежат субстанции, которые используются для приготовления лекарственных препаратов, предназначенных только для внутрисосудистого введения, и в своём составе могут иметь или получать в процессе производства примеси, обладающие депрессорным действием (субстанции микробиологического или животного происхождения).
Для испытания препаратов на наличие гистаминоподобного действия проводят определение in vitro - на изолированном отрезке подвздошной кишки морской свинки (Гистамин) (Метод 1).
Метод 2 - определение in vivo - в опытах на кошках (депрессорные вещества) необходим для подтверждения результатов метода 1 (в случае брака). Кроме этого, метод 2 используют, когда чувствительность метода 1 недостаточна (например, при испытании доксорубицина). При формировании раздела "Гистамин" для проектов нормативной документации при обосновании спецификации:
- следует привести выбор и обоснование нормы содержания гистамина в субстанции;
- выбранная норма должна обеспечивать надежность проверки качества субстанции для предотвращения реакций у больных.
В разделе "Гистамин" должны быть указаны:
1. Норма содержания гистамина
2. Растворитель - В том случае, если эти требования отличаются от требований ОФС
3. Концентрация исходного раствора - В том случае, если эти требования отличаются от требований ОФС
При включении раздела "Депрессорные вещества" для проектов нормативной документации при обосновании предлагаемых требований:
1) рекомендуется указать величину максимальной разовой терапевтической дозы, которую вводят пациенту, согласно Инструкции по медицинскому применению на лекарственный препарат, изготавливаемый из данной субстанции;
2) следует приводить выбор и обоснование тест-дозы для внутривенного введения кошке при испытании;
3) выбранная тест-доза должна обеспечивать надежность проверки качества субстанции для предотвращения аллергических реакций у больных.
В разделе «Депрессорные вещества» должны быть указаны:
1. Тест-доза
2. Растворитель
3. Объём вводимой тест-дозы - В том случае, если эти требования отличаются от требований ОФС
4. Время введения
Микробиологическая чистота. Стерильность.
Испытание субстанции на стерильность вводят в тех случаях, когда субстанция используется для производства стерильных лекарственных форм, которые не подвергаются процедуре стерилизации.
Контроль качества субстанций по показателям "Микробиологическая чистота" и "Стерильность" проводят в соответствии с требованиями и методами ГФ ХII.
Отбирают образец в количестве 10 г (мл) (категории 1.2.Б и 2.2) и 30 г (мл) (категории 3.2 и 4.2). Образец субстанции для анализа по микробиологическим показателям может быть менее 10 г (мл), указанных в ГФ ХII, в случае высокой цены или ограниченного количества образца, но не менее 1,0 г, если нет других указаний в нормативной документации.
Если субстанция относится к категории 1.2.А, т.е. удовлетворяет требованиям по показателю «Стерильность», образец должен быть упакован как стерильный продукт. Количество образца для анализа определяет ОФС «Стерильность».
Необходимо представлять информацию о наличии или отсутствии антимикробного действия испытуемых образцов в отношении тест-штаммов, указанных в ГФ ХII.
Метод мембранной фильтрации может использоваться при растворимости субстанции в водных растворителях. Если при посеве метод мембранной фильтрации методически отличается от изложенного в ГФ ХII, необходимо кратко изложить особенности пробоподготовки образцов и проведения мембранной фильтрации и учета результатов контроля.
В некоторых случаях для устранения антимикробного действия при посеве на питательные среды используют инактиватор (название, концентрацию, количество), который прибавляют в разбавитель и (или) в питательные среды в количестве .... г (мл).
Если субстанция обладает в отношении конкретного одного или нескольких микроорганизмов ярко выраженным антимикробным действием, которое не снимается доступным разведением или с помощью инактиваторов, а выполнить испытание методом мембранной фильтрации невозможно из-за физико-химических свойств (нерастворимости) образца, испытание на микробиологическую чистоту проводят, исключая исследование на конкретный один или несколько микроорганизмов.
Количественное определение
Для определения содержания активного вещества предпочтительнее использовать классические титриметрические методы, рекомендуется их сочетание с современными физико-химическими методами анализа (ИК- и УФ-спектрофотометрия, ВЭЖХ, ТСХ и др.), используемыми для идентификации субстанций и контроля примесей. В случае солей обычно достаточно анализа только одного из ионов — предпочтительнее фармакологически активного. При необходимости определяют биологическую активность.
Если определение содержания активного вещества невозможно, проводят определение таких количественных показателей, которые связаны с содержанием активного вещества субстанции.
При использовании титриметрического метода для количественного определения при описании методики указывают величину точной навески субстанции, взятой для анализа, растворитель, необходимые операции по подготовке испытуемого раствора, титрант и способ установления конечной точки титрования (используемый индикатор в случае визуальной оценки, применяемые электроды при потенциометрическом титровании и др.).
Формулу расчета не приводят. Указывают содержание анализируемого вещества в миллиграммах, эквивалентное 1 мл точно указанной молярной концентрации титранта.
При использовании для количественного определения метода спектрофотометрии приводят описание приготовления испытуемого раствора, стандартного раствора (при использовании стандартного образца) с указанием применяемого прибора, длины волны в максимуме поглощения, толщины слоя (длины оптического пути), раствора сравнения и формулы расчета с расшифровкой обозначений в формуле с указанием размерности используемых величин.
Если методика определения предусматривает использование величины удельного показателя поглощения вещества, то это значение должно быть обосновано.
При использовании метода ВЭЖХ порядок изложения раздела «Количественное определение» должен быть следующим:
Количественное определение. Метод ВЭЖХ
Используемые реактивы: с указанием категории (квалификации), фирмы-производителя, каталожного номера (в тех случаях, когда они не описаны в гФ) (с добавлением ("или аналогичного качества").
Используемые стандартные образцы: приводится перечень с указанием химических названий, квалификации, производителя (при необходимости).
Описание приготовления всех растворов, используемых в методике с указанием допустимых сроков годности и условий хранения приготовленных растворов в следующей последовательности:
Растворы реагентов (при необходимости)
Буферный раствор рН ... (при необходимости)
Подвижная фаза (с описанием приготовления вспомогательных растворов, входящих в состав подвижной фазы) (при необходимости)
Раствор внутреннего стандарта (при его использовании)
Испытуемый раствор
Раствор(-ы) стандартного(-ых) образца(-ов) или Раствор(-ы) сравнения
Раствор для проверки пригодности хроматографической системы
Хроматографические условия
Колонка - Указывается размер колонки, сорбент, размер частиц. Рекомендуется указывать как минимум две альтернативные колонки. Допускается использование альтернативной колонки, удовлетворяющей требованиям пригодности хроматографической системы
Подвижная фаза (ПФ)
Скорость потока
Детектор - Для УФ-детектора указывают длину волны
Температура колонки - Указывается конкретная температура
Объем пробы
Время хроматографирования
В случае использования линейного градиента следует приводить запись в виде таблицы с обозначениями времени и состава подвижной фазы.
Определение пригодности хроматографической системы. Приводится описание методики определения и указываются требования к параметрам, характеризующим форму пика (эффективность колонки и фактор асимметрии), к разделительной способности (при наличии нескольких определяемых веществ) и относительному стандартному отклонению площадей пиков.
Замечания по процессу. Указывается, как при необходимости могут быть изменены условия хроматографирования для достижения критериев пригодности хроматографической системы; каким образом должна быть кондиционирована колонка, каким растворителем промывается колонка после использования и как она консервируется, если эти специальные требования необходимы для стабильной работы колонки, а также другие уточнения, которые могут облегчить проведение испытаний в процессе контроля качества субстанции и предотвратить нежелательный контакт колонки с компонентами подвижной фазы или пробы.
Методика определения. Приводится подробное описание всех этапов выполнения методики, требующих особого внимания, развернутая формула расчета с расшифровкой обозначений в формуле и указанием размерности используемых величин.
Упаковка, Хранение
Упаковка и условия хранения должны обеспечивать качество субстанции в течение установленного срока годности.
Указание "хранить в сухом месте" означает:
- субстанция должна храниться в воздухонепроницаемой таре;
- при вскрытии первичной упаковки во влажной атмосфере необходимо проявлять осторожность;
- при необходимости низкое содержание влаги можно поддерживать с помощью осушающих веществ, при условии, что их прямой контакт с субстанцией будет исключен.
Указание «в защищенном от света месте» означает, что
- первичная упаковка должна быть изготовлена из материала, в достаточной степени поглощающего свет, способный вызвать фотохимические превращения
или
- первичная упаковка должна быть помещена во вторичную упаковку, обеспечивающую такую защиту
или
- субстанция должна храниться в темном месте, исключающем возможность попадания света.
При указании температурных условий хранения рекомендуется использовать числовые выражения, соответствующие условным терминам, принятым Государственной фармакопеей РФ.
Маркировка
Должна включать торговое и международное непатентованное название, указание "субстанция", название компании-держателя регистрационного удостоверения, её адрес, информацию о назначении субстанции, количество лекарственного средства в упаковке, дату выпуска, номер серии, срок годности, условия хранения, предупредительные надписи, меры предосторожности (при необходимости).
Если компания-держатель регистрационного удостоверения не совпадает с производителем, на упаковке дополнительно приводится информация о производителе (название фирмы, страна, адрес).
Срок годности
Срок годности субстанций определяется временем, в течение которого она соответствует требованиям нормативной документации. Срок годности субстанции может быть установлен хранением при обычных условиях или методом «ускоренного старения» при повышенной температуре.
Назначение
Указывается, что субстанция предназначена
«Для приготовления стерильных лекарственных форм»
или
"Для приготовления нестерильных лекарственных форм»
или
"Для приготовления стерильных неинъекционных лекарственных форм".
Стандартные образцы.
Современные методы анализа предусматривают использование стандартных образцов. В качестве стандартных образцов при анализе фармацевтических субстанций следует использовать фармакопейные стандарты (например, ЕР CRS, BP CRS, USP RS и др.). При использовании фармакопейных стандартных образцов для анализа следует учитывать область их применения (для снятии ИК-спектра, для количественного определения и тп.).
Содержание
Правила составления, изложения и оформления стандартов качества на фармацевтические субстанции Методические рекомендации (вступление)
Введение
I Порядок представления стандартов качества предприятия на фармацевтическую субстанцию на экспертизу и согласование
II. Правила составления стандартов качества предприятия на субстанции
III. Макет нормативной документации на субстанцию
|