|
Содержание
Правила составления, изложения и оформления стандартов качества на фармацевтические субстанции Методические рекомендации (вступление)
Введение
I Порядок представления стандартов качества предприятия на фармацевтическую субстанцию на экспертизу и согласование
II. Правила составления стандартов качества предприятия на субстанции
III. Макет нормативной документации на субстанцию
I. Порядок представления стандартов качества предприятия на фармацевтическую субстанцию на экспертизу и согласование
1. Проект стандарта качества предприятия на лекарственное средство, подписанный руководителем предприятия (фирмы) или другим уполномоченным лицом с печатью и указанием даты, представляется в соответствии с требованиями соответствующих административных регламентов.
2. Обоснование спецификации должно содержать следующие сведения и данные:
- указание, является ли лекарственное средство оригинальным или воспроизведенным;
- подробное обоснование приведенных в проекте нормативной документации показателей, методов исследования и норм, а также описание других методов, по которым проводился анализ данного лекарственного средства;
- при переоформлении регистрационного удостоверения или пересмотре нормативной документации — сравнительную таблицу, в которой приведена информация о месте (-ах) нахождения юридического (-их) лиц (а) и адресе (-ах) всех стадий производства фирмы-производителя (-ей) лекарственного средства, технологии получения, показателях, методах контроля и нормах, упаковке, сроке годности и условиях хранения в проекте и пересматриваемой нормативной документации;
- таблицу сравнительных требований к качеству лекарственных средств в ГФ Российской Федерации и ведущих зарубежных фармакопеях.
3. Все представляемые материалы (схема производственного процесса, методы контроля процесса производства, таблицы стабильности, валидация аналитических процедур и т.д.) должны быть заверены подписью руководителя - предприятия (фирмы) или ответственного лица с печатью и указанием даты.
4. для субстанций зарубежного производства дополнительно представляются оригинальные материалы по методам контроля качества субстанции, валидации аналитических процедур, результаты исследования стабильности) сертификаты анализа.
Общие положения
1. Текст нормативной документации должен быть изложен в третьем лице множественного числа.
Сокращение слов в тексте и надписях под рисунками, схемами и другими иллюстрациями не допускается, за исключением сокращений, применяемых в законодательстве Российской Федерации и Государственной фармакопее РФ (далее ГФ).
2. Текст методик должен быть изложен четко и ясно, чтобы исключить любые затруднения в отношении проведения анализа.
3. При разработке методов анализа следует использовать реактивы и их растворы, титрованные растворы и индикаторы, приведенные в действующей ГФ. Если они в ней не приведены, то следует характеризовать реактив, указан его квалификацию и регламентирующую его качество нормативную документацию, и включать описание приготовления растворов, индикаторов и титрованных растворов.
4. Если требования, методы, нормы и т.п, распространяемые на лекарственное средство, установлены в Государственной фармакопее или государственном стандарте качества лекарственных средств, то вместо повторения текста следует давать ссылку на источник. В остальных случаях приводится полное описание методики, требований и т.д.
5. Текст нормативной документации должен быть напечатан через 1,5 интервала, шрифт 14 (Times New Roman, обычный), спецификация — шрифт не менее 12, отступ от верхнего, нижнего и левого краев листа — на З см, а от правого края листа — на 1,5 см.
Примечание должно быть напечатано через 1,0 интервал, шрифт 14. Слово "Примечание" выделяется полужирным шрифтом. Если примечание одно, то его текст печатается сразу после слова "Примечание",
если несколько — то под номерами, каждое (в том числе первое) с красной строки. Название примечания. (при его наличии) подчеркивают.
Применяемые термины и условные обозначения
а - навеска испытуемого образца;
а0 - навеска стандартного образца;
m - масса;
С - концентрация вещества в растворе;
V - объем;
W - содержание воды;
N - разведение;
Р - содержание основного вещества в стандартном образце в процентах или в десятичных долях.
Хроматографические методы
t - время удерживания вещества;
t0 - время удерживания несорбирующегося вещества;
tR = t - t0 - приведенное время удерживания;
k′ = (t - t0) / t0 - коэффициент емкости вещества;
Rr = (t2 / t1) - относительное время удерживания;
r = (t2 - t0) / (t1 - t0) - относительное удерживание;
W - ширина пика у основания;
W0,5 - ширина пика на половине высоты;
R - разрешение между пиками;
p / v - коэффициент - отношение высоты пика примеси к высоте низшей точки кривой, разделяющей пики примеси и основного вещества относительно экстраполированной базовой линии;
N - число теоретических тарелок;
Т - фактор асимметрии пика (хвостовой фактор);
ƒ - расстояние между перпендикуляром, опущенным из максимума пика, и восходящей стороной пика на 5 % его высоты;
S - площадь пика на хроматограмме испытуемого раствора;
S0 - площадь пика на хроматограмме раствора стандартного образца.
В планарной (тонкослойной, бумажной) хроматографии
Rƒ - фактор удерживания;
Rs = Rƒ1 / Rƒ2 - относительный фактор удерживания.
Спектрофотометрические методы
А - оптическая плотность;
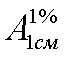 - удельный показатель поглощения; - удельный показатель поглощения;
b - толщина поглощающего слоя.
Буквенные обозначения в тексте и формулах приводятся курсивом, а подстрочные и надстрочные к ним — обычным шрифтом, например, 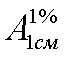
Содержание
Правила составления, изложения и оформления стандартов качества на фармацевтические субстанции Методические рекомендации (вступление)
Введение
I Порядок представления стандартов качества предприятия на фармацевтическую субстанцию на экспертизу и согласование
II. Правила составления стандартов качества предприятия на субстанции
III. Макет нормативной документации на субстанцию
|